A ligação de hidrogênio é uma atracção entre um átomo de hidrogênio (carregado positivamente) com um átomo de pequena altamente eletronegativo, tal como flúor (F), o oxigênio (O) ou azoto (N) (FH, OH, NH), que tem um par de elétrons livres ( carga negativa ), daí o nome “ligação de hidrogênio”, que não deve ser confundido com uma ligação covalente a átomos de hidrogênio ). Uma ligação de hidrogênio é, na verdade, uma atração dipolo-dipolo entre moléculas que contêm esses três tipos de junções polares.
Esse tipo de atração tem apenas um terço da força das ligações covalentes, mas tem efeitos importantes nas propriedades das substâncias nas quais elas ocorrem, especialmente em termos de pontos de fusão e ebulição nas estruturas cristalinas.
Ligações de hidrogênio , são formados por átomos de Hidrogênio localizado entre átomos pequenos altamente eletronegativos, quando um átomo de hidrogênio está ligado covalentemente a um átomo eletronegativo, oxigênio , azoto ou de flúor , átomo com maior eletronegatividade atrair electrões de ligação própria , formando um dipolo negativo, enquanto o átomo de hidrogênio, produzindo parcialmente seus elétrons, gera um bipolo de carga positiva em seu ambiente. Essas cargas opostas são atraídas. Essa deficiência parcial de elétrons torna os átomos de hidrogênio suscetíveis à atração por elétrons não compartilhados nos átomos de Oxigênio, Nitrogênio ou Flúor.
A ligação de hidrogênio é um caso especial da interação dipolo-dipolo, é relativamente fraca entre -20 e -30 kJ mol -1, a resistência de união aumenta com o aumento da eletronegatividade e diminui com o tamanho dos átomos participantes.
Ligação de hidrogênio Intermolecular

Das forças intermoleculares, a ligação de hidrogênio é a maior, sua força está entre 5 e 30 kJ por mole, mas há casos em que ela atinge 155 kJ por mole. A ligação de hidrogênio intermolecular é responsável por muitas das qualidades da substância.
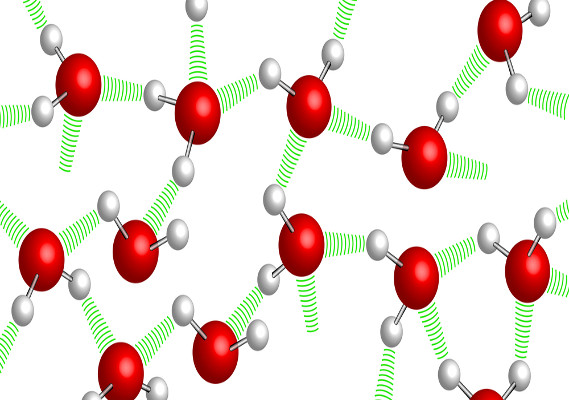
Uma molécula de água é formada entre um átomo de oxigênio com seis elétrons de valência (compartilha apenas dois e tem dois pares de elétrons livres) e dois hidrogênios com um elétron de valência cada (ambos produzem seu único elétron para o oxigênio para completar byte), como uma molécula electrões polares envolvidos nas suas ligações, que estão mais próximas para o oxigênio que os átomos de hidrogênio e, portanto, duas cargas parciais negativos são gerados na extremidade onde é oxigênio e duas cargas positivas parciais no final, onde os hidrogênios são. A presença de cargas parciais positivas e negativas faz com que as moléculas de água se comportem como ímãs nos quais as partes com carga parcial positiva atraem as partes com cargas parciais negativas.
De tal maneira que uma única molécula de água pode ser unida a 4 outras moléculas de água através de 4 ligações de hidrogênio. Esta multiplicidade de ligações pela ligação de hidrogênio é o que dá qualidades especiais à água.
Estudos de difração de raios- X indicam que a distância entre os átomos de oxigênio que estão envolvidos na ligação de hidrogênio são separados por 0,28 nm, o que indica um arranjo tetraédrico das moléculas de água.
A estrutura de água favorece interações para formar ligações de hidrogênio , o arranjo é sempre perpendicular entre as moléculas participantes é também favorecido por cada protão ligado ao oxigênio muito eletronegativo encontra um electrão não compartilhado com os quais ele interage 1-1. Do exposto conclui-se que cada átomo de oxigênio na água pode formar, através de seu par livre de elétrons, duas ligações de hidrogênio e, além disso, os dois átomos de hidrogênio da molécula formam mais duas ligações. Esta característica é o que faz da água um líquido muito especial, sua ebulição, fusão e viscosidade são surpreendentemente altas.
Ligação de hidrogênio intramolecular

Pode ocorrer dentro da mesma molécula, estão envolvidos na formação de estruturas secundárias, terciárias e quaternárias de proteínas e na estabilidade de ácidos nucleicos. Neste último, as ligações de hidrogênio são aquelas que unem os pares de bases dos dois filamentos de DNA, formando a dupla hélice.
Nessas macromoléculas, a ligação de hidrogênio entre partes da mesma molécula faz com que ela se curve em uma forma específica, o que ajuda a determinar o papel fisiológico ou bioquímico da molécula. Por exemplo, a estrutura de dupla hélice do DNA é principalmente devido às ligações de hidrogênio entre os pares de bases, que ligam uma cadeia complementar à outra e permitem a replicação.
