Ligação metálica é o nome dado à ligação química que ocorre entre os átomos de metal em conjunto (de ligação entre os núcleos atômicos e electrões de valência, agrupados em torno deles como uma nuvem).
É uma ligação forte, primária, que é formada entre elementos da mesma espécie, nesta ligação todos os átomos envolvidos perdem elétrons de suas camadas externas, que se movem mais ou menos livremente entre eles, formando uma nuvem eletrônica (também conhecida como mar de elétrons).
É o tipo de link que ocorre quando os elementos metálicos são combinados; isto é, elementos de baixa eletronegatividade e que diferem pouco.
Estrutura da substância metálica

Os átomos dos metais são agrupados muito próximos, o que produz estruturas muito compactas. Estas redes dimensionais aquisição de estruturas, tais como típicas esferas compacto embalagem (HEP), cara cúbica centrada ou centrado corpo cúbico em três dimensões.
Neste tipo de estrutura cada átomo de metal é cercado por doze outros átomos (seis no mesmo plano, três acima e três abaixo).
Além disso, devido à baixa eletronegatividade possuindo metais, os electrões de valência são extraídos das suas orbitais e têm a capacidade de mover-se livremente através do composto de metal, o que lhe confere as propriedades eléctricas e térmicas. Esta ligação só pode ser apresentada em substâncias no estado sólido.
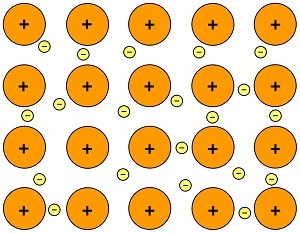
Elementos com uma ligação de metal estão compartilhando um grande número de elétrons de valência, formando um mar de elétrons ao redor de uma rede gigante de cátions.
Muitos dos metais têm pontos de fusão mais elevados do que outros elementos não metálicos, portanto, pode-se inferir que existem ligações mais fortes entre os diferentes átomos que os compõem. A ligação do metal não é polar, não é pouca diferença na eletronegatividade entre os átomos envolvidos na interação da ligação (em metais elementares puros) ou muito pouco (em ligas), e electrões envolvidos no que consiste na interação através da estrutura cristalina do metal.
Propriedades da substância metálica

A ligação metálica explica muitas características físicas de substâncias metálicas, como força, maleabilidade, ductilidade, condução de calor e eletricidade e brilho ou brilho (elas retornam a maior parte da energia luminosa que recebem).
Ligação metálica é a atração eletrostática entre átomos de metal ou cátions e elétrons deslocalizados. Essa é a razão pela qual um deslizamento de camadas pode ser explicado, resultando em sua característica maleabilidade e ductilidade. Eles apresentam o chamado “efeito fotoelétrico”; isto é, quando estão sujeitos a uma radiação de determinada energia, emitem elétrons. Eles geralmente se dissolvem uns nos outros, formando soluções que são chamadas de ligas.
Os átomos de metal têm pelo menos um elétron de valência, não compartilham esses elétrons com átomos vizinhos nem perdem elétrons para formar íons. Em vez disso, os níveis de energia externos dos átomos de metal se sobrepõem. Eles são como ligações covalentes identificadas.
Modelo da nuvem de elétrons:

De acordo com este modelo, os átomos metálicos produzem seus elétrons de valência para uma nuvem eletrônica que compreende todos os átomos do metal. Assim, a ligação metálica resulta da atração eletrostática entre os resíduos positivos e os elétrons móveis que pertencem como um todo à rede metálica.
Na ligação de metal, os elétrons não pertencem a nenhum átomo dado. Além disso, é um link não gerenciado, porque a nuvem eletrônica é comum a todos os remanescentes atômicos que compõem a rede.
É necessário esclarecer que os átomos, quando cederam os elétrons à nuvem comum, não são realmente íons, já que os elétrons estão dentro da rede, pertencentes a todo o resto positivo.
Este modelo é muito simples e serve para interpretar muitas das propriedades dos metais; embora tenha certas limitações, principalmente na explicação da condutividade diferente de alguns metais.
